Asimilación de CO2 en dos especies de plantas de un bosque húmedo tropical de Cerro Pelado, Gamboa
Kleveer Espino
Centro de Investigaciones Hidráulicas e Hidrotécnicas
Universidad Tecnológica de Panamá
[email protected]
José R. Fábrega D.
Centro de Investigaciones Hidráulicas e Hidrotécnicas
Universidad Tecnológica de Panamá
[email protected]
Resumen - En el sotobosque de los bosques tropicales, la radiación incidente está delimitada por la cobertura boscosa, que filtra la luz. Este trabajo emplea la radiación fotosintéticamente activa artificial (PAR en inglés) para evaluar la eficiencia fotosintética y la asimilación máxima en dos especies dentro de una parcela circular de 450 m2 ubicada dentro del Observatorio de Hidrología Tropical de Cerro Pelado (OHTCP), Gamboa, Panamá. El OHTCP consiste en una micro Cuenca experimental de 16.4 Hectáreas, con una precipitación anual total de aproximadamente 2100 mm Las mediciones de la asimilación de CO2 se realizaron entre las 10:00 y 14:30 horas, de junio de 2012 a noviembre de 2013, a temperatura ambiente (28-32 °C), humedad relativa entre 70-90 %, y presión de 1 atmósfera. Las intensidades de luz variaron entre 0 a 500 de PAR, para un flujo de 100 µmoles de CO2 . Condiciones de luz constante fueron simuladas con una luz LED 6400-02B. Las especies estudiadas fueron Rynorea sylvatica y Oenocarpus mapora. Rynorea sylvatica presentó una eficiencia fotosintética máxima de 4.12µmol de CO2 /m2s, mientras que Oenocarpus mapora registró 3.70 µmol de CO2 /m2s (época lluviosa) Estas especies registraron valores de asimilación máximos de 3.82 y 3.29 µmol de CO2 /m2s (época seca). Para ambas especies se establecieron puntos de compensación fotosintética (Ic) sin asimilación neta de CO2. Al disminuir la conductancia intracelular la asimilación neta de CO2 aumenta. Estos resultados preliminares indican que ambas especies presentan Ic por debajo de 100 µmol de fotones/m2s y relaciones de A vs PAR, r2= 0.99.
Palabras Claves: Fotosíntesis, Carbono, Capacidad estomática, Radiación Fotosintéticamente Activa (PAR), Punto de compensación, Concentración intra-celular, Cerro Pelado Gamboa.
Abstract – In the understory of tropical rainforest, the incident radiation is limited by light filtered by the forest cover. This work employs artificial photosynthetic active radiation (PAR) to evaluate the photosynthetic efficiency and the maximum assimilation in two species within a 450 m2s circular plot located at the Cerro Pelado Tropical Hydrology Observatory (CPTHO) in Gamboa, Panamá. The CPTHO consists in an 16.4 Ha experimental microbasin, with an annual precipitation of approximately 2100 mm. The measurements of CO2 assimilation were taken between 10:00 and 14:30 hours, since June 2012 until November 2013, with a temperature of (28-32 °C), relative humidity between 70- 90%, and 1 atmosphere. Light intensities varies from 0 to 500 of PAR, for a CO2 flow of 100µmoles. Constant light conditions were simulated with a LED 6400-02B. Th especies studied were Rynorea sylvatica and Oenocarpus mapora. Rynorea sylvatica presented a máximum photosynthetic efficiency of 4.13mol CO2/ms, while Oenocarpus mapora 3.70 µmol de CO2 /m2s (wet season). These species registered máximum assimilation values of 3.82 and 3.29 µmol de CO2 /m2s (dry season) Both species established photosynthetic compensation points (Ic) without net assimilation of CO2. Lower intracellular conductancies, correspond to higher net CO2 assimilation. These preliminary results indicates that both species show Ic bellow 100 µmol of photons/m2s.and A vs PAR relationships with a r2= 0.99.
Keywords: Photosyntesis, Carbon, Estomatic Capacity, Photosynthetic Active Radiation (PAR), Compensation point, Intracellular concentration, Cerro Pelado Gamboa.
Tipo de artículo: Original
Fecha de recepción: 3 de septiembre de 2014
Fecha de aceptación: 19 de noviembre de 2014
1. Introducción
La fotosíntesis es un proceso que permite la asimilación de CO2 que representa la base de la productividad de un ecosistema, a partir de aquí se da la acumulación de nutrientes en distintas partes de la planta [1-2].
Los bosques tropicales se caracterizan por diferentes intensidades lumínicas que van desde condiciones de sombra en el sotobosque, hasta intensidades lumínicas muy altas en los claros y en el dosel. [3-4]. Dentro del bosque, la calidad y cantidad de luz varían espacialmente y temporalmente a diferentes escalas; en un sotobosque, bajo dosel cerrado, las intensidades de luz son extremadamente bajas en la mayor parte del día, lo que hace que la capacidad fotosintética y las tasas de crecimiento de las plantas sean bajas. [5]. La fotosíntesis es un proceso fisiológico de los organismos con clorofila, que permite la asimilación de CO2; representa la base de la productividad de un ecosistema, a partir de aquí se dará la acumulación de nutrientes en distintas partes de la planta.
Las plantas usan la energía lumínica procedente del sol, el CO2 atmosférico y agua para realizar la fotosíntesis, y así formar su biomasa la cual se acumula en troncos, ramas, corteza, hojas y raíces.
Las plantas como todo ser vivo también emiten CO2 mediante la respiración, pero en cantidades menores con un balance negativo, contribuyendo de manera significativa a la disminución del CO2 atmosférico. La fotosíntesis se divide en dos etapas: Fase lumínica o electroquímica y fase oscura o química, desarrollándose ambas en estructuras especializadas de la hoja.
Durante la fase lumínica la energía está asociada a los fotones; comprendida en el espectro de luz visible(400-700 nm), es capturada por los pigmentos fotosintéticos y transformada en energía y ésta a su vez, en moléculas con poder reductor en forma de NADPH+ H+ y energía química del enlace del ATP y oxigeno molecular a partir de moléculas de agua por reacciones denominada fotolisis.
La capacidad de las plantas de acumular carbono dependerá de la capacidad fotosintética de las especies y la intensidad de luz, sin embargo las plantas del sotobosque de las selvas tropicales se encuentran creciendo en condiciones de baja intensidad de luz. [6-7].
Sin embargo, en las regiones tropicales la radiación fotosintéticamente activa (PAR) está alrededor de 1800µmol de fotones /m2s, pero dentro del sotobosque sólo se recibe de un 4 al 10% de la radiación [8].
Por otro lado se ha encontrado que el aumento en el CO2 atmosférico es debido al crecimiento de especies agrícolas y otras actividades del hombre [9]. La concentración de CO2 atmosférico de acuerdo al IPCC para noviembre de 2012 estaba alrededor de 392 ppm. [10-11]. Estos valores son preocupantes, si consideramos que las concentraciones, por el orden de 350 µmol de CO2 imponen un límite para la asimilación en plantas C3 [12-15].
La capacidad de las plantas de acumular carbono dependerá de otros factores como la temperatura, intensidad de luz, concentración atmosférica entre otros [16-18].
La tasa de asimilación (A) depende, obviamente del flujo de fotones fotosintéticos (PAR o PPFD)que son absorbidos por la hoja. La respuesta a la luz se caracteriza por una curva que presenta diferentes fases que se corresponden con otras tantas condiciones ambientales. [19].
Figura 1. Localización regional del área de estudio de asimilación de CO2. (Serrano, Nuñez, 2009)
2. Materiales y Métodos
2.1 Sitio de estudio
La investigación presentada se realiza en el Observatorio de Hidrología Tropical de Cerro Pelado (OHTCP), Gamboa. Esta zona se caracteriza por tener bosques húmedos tropicales ubicados en la cuenca hidrográfica del canal de Panamá. El OHTCP es utilizado para realizar investigaciones relacionadas al ciclo del agua y carbono, debido a que representa características de bosque húmedo tropical [20], es un área de fácil acceso. (Ver figura 1). Consiste en una colina bastante pronunciada que asciende abruptamente de 30 a 223 metros sobre el nivel del mar (msnm). Durante las operaciones tempranas del Canal (1920 o más tarde), Cerro Pelado fue claramente cortado en su altitud. Éste posee vegetación de crecimiento secundario. El mismo cuenta con una torre de observaciones meteorológicas, en cuya vecindad dominan árboles que alcanzan entre los 25 y 35 metros de altura. Además de estos árboles predominantes, hay algunas especies de palmas que alcanzan los 25 metros de altura que, combinados con árboles caducos emergentes, forman la capa de cubierta secundaria. Algunas palmas más pequeñas y arbustos de unos cuantos metros se pueden ver en diferentes grados en las pendientes. [21].
En cuanto al clima, la temperatura mínima promedio es de 20.5° C y la máxima alrededor de los 32° C. La precipitación promedio anual alcanza 3 500 mm y su régimen climático se caracteriza por una prolongada estación lluviosa de casi ocho (8) meses. La topografía es muy variada, observándose terrenos prácticamente planos (0-3 %), lomas ligeramente onduladas (3-15 %) y terrenos marcadamente inclinados, con pendientes entre un 30 y 60 %. El área usada en las mediciones de carbono en plantas está en una zona de bosque próximo a la parcela permanente, en el cual se realizó otro inventario forestal para determinar la abundancia relativa de especies predominantes en la zona de estudio dentro de la parcela permanente desarrollada.
Este trabajo busca conocer la capacidad fotosintética de especies del sotobosque, mediante el estudio de la asimilación del CO2 asociada a las diferentes intensidades de luz (PAR) y establecer su comportamiento estacional. Estos antecedentes muestran la relevancia de este estudio para generar información importante para el manejo adecuado de los sumideros de carbono y para la conservación de los bosques y la disminución del CO2 ambiental.
2.2 Equipos y protocolos de medición
Para el presente estudio se realizó un inventario de una parcela circular de 450 m2 en Cerro Pelado, Gamboa. Se utilizó como punto de referencia central, el árbol de mayor tamaño (Luehea seemanii), para proceder a identificar e inventariar la flora existente.
De aquí, se establecieron las dos especies de arbustos más predominantes. (Tabla 1). Para estas especies se realizaron mediciones de flujo de carbono a través del cálculo de la medición de la tasa de asimilación de CO2 en función de la Radiación Fotosintéticamente Activa (PAR).
Seutilizaronhojasmadurasdelapartesuperiorde las plantas, las cuales se encontraban influenciadas por la cantidad de sombra producto de las copas de los árboles de mayor elevación ubicados próximos a las especies estudiadas, básicamente dependían de los destellos de luz solar que penetraban hacia el interior del sotobosque durante el período de aproximadamente 12 horas.
Para la medición de CO2 en plantas se empleó el equipo de intercambio de gases LI-COR 6400XT (Previamente calibrado de acuerdo a las especificaciones del fabricante), el cual cuantifica la asimilación del CO2 y tiene la capacidad de suministrar la cantidad de radiación incidente a través de un sensor de radiación interno.
El LI-COR 6400 XT es un analizador de intercambio de gases para la medición de fotosíntesis, fluorescencia y respiración de suelo. Para la medición de fotosíntesis, bajo el dosel del bosque fue necesaria la adaptación de una cámara de luz roja–azul 6400-02B de 2 x 3 cm. (Li-Cor).
Durante el proceso de medición, el analizador de gases permite cuantificar la cantidad de CO2 absorbido por la planta y describe la relación que se presenta con las variaciones de intensidades (PAR). El LI-6400XT utiliza un motor para mover el CO2 a través de la cámara que permite la inyección constante de una cantidad fija de CO2 hacia las estomas de la planta para el intercambio de gases procedentes del ambiente o en su defecto suministrado por cilindros de CO2 para asegurar un flujo constante de dicho gas [22].
Después de cada medición, los datos son descargados y utilizados para calcular la asimilación neta de flujo de CO2 por parte de las plantas. Este equipo también tiene la capacidad de medir la cantidad de luz natural procedente del sol a través de un sensor quantum, sin embargo por las características propias de la zona (mucha sombra), fue necesario emplear luz artificial con longitudes de onda entre 400 y 700 nm para simular condiciones naturales.
Mediciones de Flujo de Carbono en plantas. Las mediciones se realizaron en las especies antes indicadas entre las 10:00 y las 14:00 horas y con humedad relativa entre los 70 y 95 %, y a un flujo de 100 µmol de CO2.
Se realiza la calibración del equipo, lo cual consiste en establecer el control de parámetros como cantidad de agua y flujo de CO2 a través de los analizadores de gases (Irgas), intensidades de luz (Cantidad de Radiación Fotosintéticamente Activa (PAR). Se programa el equipo para realizar las mediciones de asimilación neta de CO2 y otros parámetros de interés.
Luego de realizado el procedimiento descrito en el párrafo anterior, se coloca la hoja de la especie a medir en la cámara de 2 x 3 cm, de luz roja-azul, con un flujo constante de 100 µmol de CO2 a diferentes intensidades de PAR (O a 500 µmol de fotones/m2s) de forma ascendente para ir cargando los fotosistemas I y II propios de las plantas, hasta llegar al máximo de asimilación. Durante el período de medición se toman en cuenta aspectos como: la humedad, tipo de clima, hora de la medición. Las mediciones se realizan después que la hoja se ha acondicionado a la intensidad de luz. Posteriormente se toman cinco mediciones puntuales de asimilación de CO2, a una intensidad lumínica pre establecida, el resultado obtenido de la capacidad fotosintética es conocido como A.
3. Resultados
3.1 Especies Identificadas
Se identificaron un total de 80 plantas representadas en 19 familias y 23 especies entre árboles y arbustos. Entre las principales familias identificadas están: Arecaceae, Violaceae,Lecythidaceae, Tiliaceae. (Ver tabla 1). Este inventario mostró que Gustavia superba es la especie de mayor frecuencia dentro de esta parcela, sin embargo los arbustos como Rinorea sylvatica y Oenocarpus mapora, presentaron las mejores facilidades para realizar la medición y las mismas estaban bajo luz atenuada dentro del sotobosque. (Ver figuras 2-3).
Tabla 1. Resultados del Inventario realizado en una parcela de 450 m2 dentro del OHTCP.
Familia Especie Cantidad % Rubiaceae Alseis blackiana 1 1.25 Arecaceae Astrocatyum standleyanum 1 1.25 Fabaceace/caes Bauhinia sp 1 1.25 Connaraceae Conareus panamensis 1 1.25 Connaraceae Conarus sp 1 1.25 Sapindaceae Cupania 1 1.25 Rubiaceae Exostema mexacanum 1 1.25 Meliaceae Guarea Guidonia 1 1.25 Lecythidaceae Gustavia superba 23 28.75 Erithropalaceae Heisteria concinna 2 2.50 Lindackeria laurina 2 2.50 Achariaceae Luehea seemannii 1 1.25 Tiliaceae Miconia affinis 2 2.50 Melastomataceae Oenocarpus mapora 1 1.25 Arecaceae Pentagonia macrophylla 8 10.00 Rubiaceae Poulsenia macrophylla 1 1.25 Moraceae Poulsenia armata 1 1.25 Burseraceae Protium panamense 2 2.50 Violaceae Rinosea sylvatica 13 16.25 Leguminosae Swartzia simplex 2 2.50 Meliaceae Trichilia tuberculata 6 7.50 Polygonaceae Triplaris cumingiana 1 1.25 Myristicaceae Virola sebifera 7 8.75
Figura 2. Rinorea sylvatica Familia: Violaceae Fuente: Tomada por el autor.
Figura 3. Oenocarpus mapora Familia: Arecaceae Fuente: Tomada por el autor.
3.2 Mediciones de flujo de carbono
Se realizaron mediciones de la tasa de asimilación de CO2 en función del PAR para el período comprendido entre junio de 2012 y noviembre de 2013. En la figuras 4 y 5 se presentan los promedios máximos de asimilación para diferentes valores de PAR. En general, el límite máximo de saturación en ambas especies se produjo para valores de PAR de 500 µmol de fotones/m2s.
Resultados época lluviosa. En la época lluviosa, los valores máximos de saturación fueron de 4.12,y 3.70 µmol de CO2/m s para Rinorea sylvatica y Oenocarpus mapora respectivamente (Ver figura 4). Igualmente, en ambos casos, los puntos de compensación fotosintética (Ic) estuvieron por debajo de los 100µmol de fotones/m2s, sin asimilación neta de CO2 próximo a los 380 µmol de CO2 /mol. La respuesta a la luz para ambas especies se caracteriza por una curva con varias fases. Para intensidades de luz extremadamente bajas, la asimilación del CO2 (fotosíntesis neta) presenta una cinética lineal. Luego en una fase de transición, esta respuesta diverge de la respuesta lineal, para finalmente llegar a una fase de saturación en la que el CO2 empieza a limitar la respuesta fotosintética. Hacia un valor de 500 μmol de fotones/m2s la tasa de asimilación disminuye, por verse saturada por la luz. (Foto inhibición) (figura 4). Las curvas de asimilación de CO2 vs PAR presentaron una relación hiperbólica con una r2= 0.99, lo que indica que la asimilación de CO2 depende de la cantidad de luz para el rango de PAR evaluado.
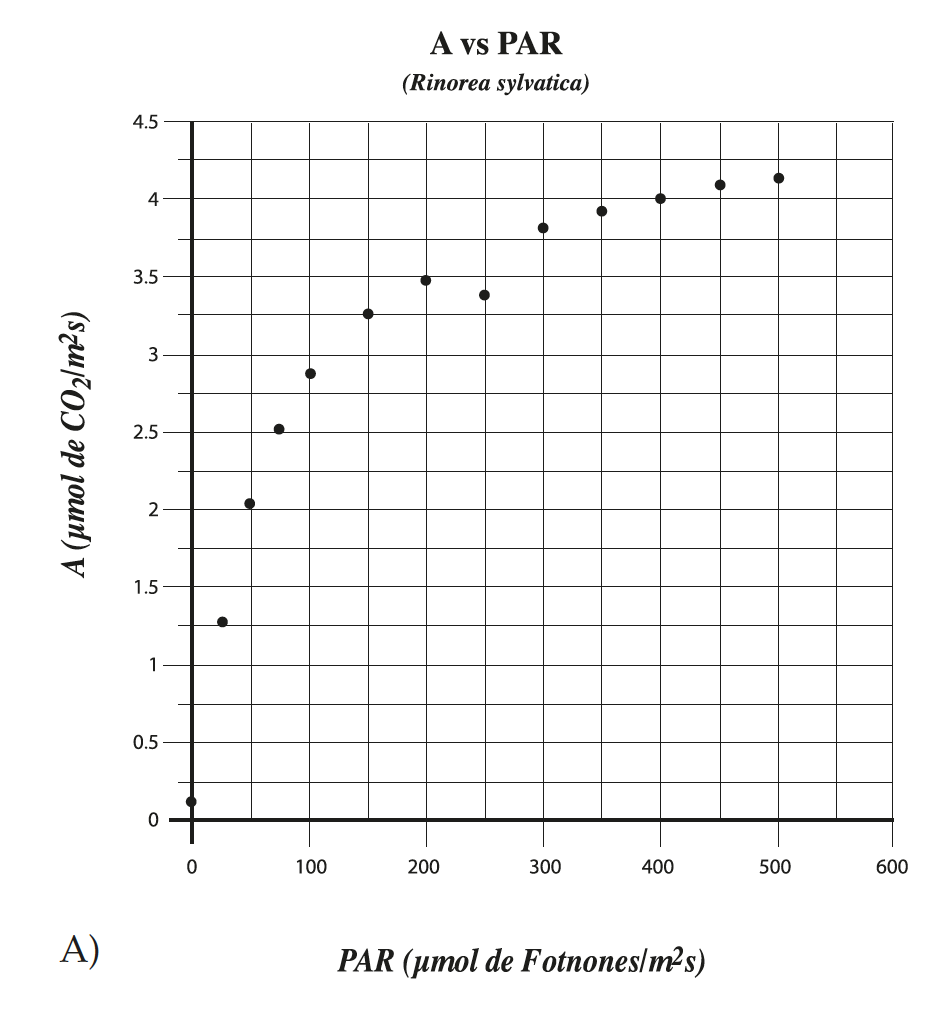
Figura 4. Respuesta de asimilación de CO2 al PAR en la época lluviosa. A) Rinorea sylvatica y B) Oenocarpus mapora. En ambos casos el r2=0.99.
Los resultados de la relación entre la asimilación de CO2 y PAR tanto para Rinorea sylvatica como para Oenocarpus mapora coinciden con lo establecido por Archontoulis et al. (2005) [23], es decir una cinética dictada por una curva polinomial hiperbólica con tres fases o estadios: uno donde la Asimilación vs PAR es creciente y corresponde a la eficiencia del uso de la luz por los cloroplastos (saturación por la luz) y una segunda fase donde la pendiente y el rendimiento de la fotosíntesis disminuyen. Aquí, la tasa de asimilación depende de la velocidad a la que se difunde el CO2 desde el exterior de la hoja hasta el cloroplasto.
Figura 5. Respuesta de asimilación de CO2 al PAR en la época seca. A) Rinorea sylvatica y B) Oenocarpus mapora. En ambos casos el r2= 0.99.
Efecto del estrés hídrico (época seca). Durante la época seca (figura 5 A y B) el estrés hídrico restringe la apertura estomática, no obstante las especies estudiadas están bajo la cobertura boscosa creándose un microclima que ha favorecido la asimilación del CO2 con valores en el orden de 3.82 µmol de CO2 /m s para Rinorea sylvatica y de 3.29 µmol de CO2 /m s para Oenocarpus mapora; otra estrategia que ha podido favorecer a esta especies es la tolerancia al estrés hídrico, la adaptación morfológica de sus hojas y la estrategia de su sistema radicular para la obtención de agua.
Una ventaja de las plantas del sotobosque es que la evaporación disminuye en el interior del dosel, se observa una atenuación de la radiación, disminuyendo la temperatura, la velocidad del viento y la humedad, favoreciendo a estas especies. Se ha determinado, que las hojas aclimatadas a la sombra, comparadas con las que se desarrollan a plena luz, tienen una menor asimilación de CO2 y menor punto de compensación
Se observó que al disminuir la cantidad del PAR a cero la asimilación de CO2 y la respiración son iguales a cero, no hay formación de compuestos orgánicos y se encuentra próximo a los 380µmol de CO2 /m s (dato no mostrado), que corresponde al punto de compensación y un r2= 0.995.
4. Conclusiones
La cinética de Asimilación de CO2 en función del PAR (Radiación Fotosintéticamente Activa) muestra que a una concentración de 100 µmol de CO2 , ambas especies alcanzan la fotosaturación a los 500µmol de fotones/m2s, sin embargo se observa que en la época lluviosa la tasa de asimilación por ambas especies es mucho mayor que para la estación seca. La condición hídrica de las especies estudiadas mostro diferencias en la asimilación de CO2 . Durante la época lluviosa se obtuvo una mayor asimilación de carbono debido a que las especies no estaban sometidas a largos periodos de sequía; se pudo observar que para Rinorea silvatica se dio una reducción de un 20 % en su actividad fotosintética con respecto al periodo seco, mientras que para Oenocarpus mapora se observó el mismo comportamiento con una disminución de un 14 % en la asimilación de CO2 . Se determinó que para un PAR cero se da una asimilación cero, el punto de compensación para ambas especies sin ganancia ni pérdida.
Cuando se alcanza el apunto de compensación fotosintética (IC), la concentración intra celular se encuentra por el orden de los 380 µmol de CO2 /mol aproximadamente (dato no mostrado).
Se determinó, que las hojas aclimatadas a la sombra, en comparación con las que se desarrolla a plena luz, tienen una menor asimilación de CO2 y menor punto de compensación [24-26].
Otra estrategia que ha podido favorecer a estas especies es la tolerancia al estrés hídrico, la adaptación morfológica de sus hojas y la estrategia de su sistema radicular para la obtención de agua. [27-29].
Finalmente, se espera extender estos estudios a otras especies, en lugares abiertos, para conocer las respuestas de asimilación de CO2 ; así como estudiar la variación de otros parámetros como la transpiración, variaciones de Ci, efectos de la temperatura y la humedad, en función de parámetros como intensidad de luz y los efectos del estrés hídrico en la asimilación de CO2 .
5. Agradecimientos
Agradecemos también a nuestros colaboradores, la Licenciada Eny Serrano y al señor Wilbert Ortiz del Centro de Investigaciones Hidráulicas e Hidrotécnicas de la Universidad Tecnológica de Panamá, por el apoyo brindado durante las mediciones de campo. De igual forma agradecemos a la SENACYT por el apoyo brindado a través del proyecto COL-07-11.
Referencias Bibliográficas
1. Von Caemmer S., Farquhar G., Some relationships between thebiochemistry of photosynthesis and gas exchange of leaves Planta 1981 153:376-387
2. Damian A, Ramírez R., Valdina C., Díaz G., Características del intercambio de gases en hojas de Guayabo (Psidium guajava) 2009 Revista Chapingo Serie Horticultura 2009 15 (2): 119-126
3. Artavia G., Eckhargt K., Araujo J., Efecto de la luz sobre la densidad y morfología de las plantas en el claro dominado por Duroira hirsuta estación biológica madre selva, rio Osora Iquitos, Perú. Revista reflexiones 2004. 83: 131-135.
4. Rodrigo R., Takahashi F., Carvalho Silva L., Franco c. Caracteristicas funcionales de las hojas de sol y sombra de especies arbóreas en un bosque de galería en el distrito Federal, Brasil 2010. Acta Bot. Bras. Vol 24 (3): 120-132.
5. Fetcher, N., Efectos del Régimen de Luz sobre la Fotosíntesis y el Crecimiento de Arboles de un Bosque Lluvioso Tropical de Costa Rica. (1987).Rev. Biol. Trop. 35 (Sulp. 1): 97-110.
6. Chazdon R, Pearcy R. Photosynthetic response to light variaton in rain forest species.1986 Oecologia 69: 517-523.
7. Pearcy R., Calkin H. Carbone dioxide Exchange of C3 and c4 tree species in the understory of hawaiian forest 1983. Oecologia 58: 26-32.
8. Baligar V., Bunce J., Elson M., and Fageria N. (2012). Photosynthetic Photon Flux Density, Carbon Dioxide Concentration and Temperature Influences Photosynthesis in Crotalaria Species. The poen Plant Sciences Journal 6: 1-7.
9.Kimball B.A., Carbon dioxide and agricultural yield: an assemblage and analysis of 430 prior observation. 1983 Agrom J. 75: 779-80
10. IPCC. Climate change 2012. (Cambio climático org.).
11. Gómez-Echverri, Luis, Editor, Cambio Climático y Desarrollo, Programa de las Naciones Unidas para el Desarrollo, y Yale School of Forestry and Environmental Studies, 2002 San José, Costa Rica.
12. Usuda H. Effect of Growth under Elevated CO2 on the Capacity of Photosyntesis in two Radish Cultivars differing in capacity of Storage root. 2004 Plant Prod. Sci (4): 377-385.
13. Bowes, G. Grouth at elevated CO2; photosyntesis responses mediated Through rubisco. 1991 Plant cell Environ 14: 795-806.
14. Long S., Ainsworth E., Rogers a., Ort D. Risisng atmosferic carbón dioxide: plant FACE and future. 2004 An Rev Plant Biol. 55: 591- 628.
15. Drake B., Leadley P., Canopy Photosyntesis of crops and native plant communities exposed to long-term elevated CO2. 1991 Plant Cell Envirn 14: 853-60.
16. Ehleringer, J., Bjorkman, O., Quantum yields for CO2 uptake in C3 and C4 plants. Dependences on temperature, CO2 and O2 concentrations. 1977 Plant Physiology 59, 86-90.
17. Santiago, L., Goldstein G., Meinzer, F., Fisher,J., Machado, K., Woodruff, D., Jones, T. Leaf photosynthetic traits scale with hydraulic conductivity and wood density in Panamenian forest canopy trees. 2004. Oecologia 140: 543-550.
18. Santiago, L., Mulkey, S. A test of exchaces measurments on excised canopy branches of ten tropical tree species. 2003. Photosynthetica 41(3) 343-347.
19. Ibañez R, Condit, R, Angehr, GR, Aguilar, S, García, T., Martínez, R, Sanjur, A., Stallard, R. F., Wright, S. J., Rand, A. S. y Heckadon, S., An ecosystem report on the Panama Canal: monitoring the status of the forest communities and the watershed: 2002.Env. Monitor. Assess. 80:65-95.
20. Serrano Eny, Nuñez María, 2009, Cuantificación de flujo de CO2 en suelo, Tesis de Grado-Universidad Tecnológica de Panamá, 2009 pág. 88.
21. López-Serrano, Francisco, 2006, El Bosque como Sumidero de CO2, Presentación en la primera jornada de Ecología y Conservación, Universidad Tecnológica de Panamá.
22. Li-Cor 6400. Portable Photosynthesis System Book 1 and 2 (10th, 2012)
23. Archontoulis S., Struik P., and Danalatos N. (2005). Leaf photosynthesis of Kenaf (C.V. Everglades 41) as affected by different light intensity and Temperature regimes. Wageningen University, Dept. of Plant Sciences, Crop and Weed Ecology Group, Haarweg 333, 6709 RZ Wageningen, The Netherlands. In press.
24. Archontoulis S., Struik P., and Danalatos N. (2005). Leaf photosynthesis of Kenaf (C.V. Everglades 41) as affected by different light intensity and Temperature regimes. Wageningen University, Dept. of Plant Sciences, Crop and Weed Ecology Group, Haarweg 333, 6709 RZ Wageningen, The Netherlands. In press.
25. Meinzer F., Goldstein G., Holbrook N., Jackson P., and Cavelier J. (1993). Stomatal and environmental control of transpiration in a lowland tropical forest tree. Plant, Cell and Enviroment 16: 429-436.
26. Naumburg E., and Ellsworth D., (2000). Photosynthetic sunfleck utilization potencial of understory saplings growing under elevated CO2 in FACE Oecologia 122: 163-174.
27. Myers, B., Duff G., Eamus D., Fordice, I. O'Grady, I., and Williams R. (1997). Seasonal variation in water relations of trees of differing leaf phenology in a wet and dry tropical Savvana near Darwin, Norther Australia. Australian Journal of Botany 45: 225-240.
28. Brodribb, T., Holbrook, N., and Gutierrez M. (2002). Hydraulic and photosynthetic co-ordination in seasonally dry tropical forest trees. Plant, Cell and Environment 25: 1435-1444.
29. Novello V. (1994). Diurnal changes of CO2 net assimilation rate and related parameters in Pistacia vera CIHEAM Options Mediterraneennes 51-55.