Typha angustifolia L. evaluada como sustrato sólido orgánico natural para biorremediar agua subterránea contaminada con nitrato
Euclides M. Deago
Centro de Investigaciones Hidráulicas e Hidrotécnicas
Universidad Tecnológica de Panamá.
[email protected]
Gonzalo E. Pizarro
Departamento de Ingeniería Hidráulica y Ambiental
Pontificia Universidad Católica de Chile.
[email protected]
Resumen – Actualmente las aguas subterráneas mantienen altos niveles de contaminación por nitrato, incremento de actividades agrícolas. En consecuencia, recientes investigaciones se han enfocado en estudiar Sustratos Sólidos Orgánicos Naturales (SSON) para biorremediar las aguas subterráneas, obteniendo resultados alentadores. Sin embargo, aún existen aspectos que deben profundizarse, tales como el aporte de nutrientes desde los SSON, que son fundamentales para la desnitrificación. Para ayudar a clarificar estos aspectos, investigamos Typha angustifolia L. (T. angustifolia) como SSON. En este artículo presentamos resultados de ensayos de desnitrificación realizados en reactores batch con material detrítico de T. angustifolia colectado en invierno y verano. La liberación de DQO por hidrólisis durante el ensayo de invierno (115 mg DQO/día) casi duplicó al valor obtenido en verano (60 mg DQO/día). Se observaron similares rendimientos de desnitrificación usando carbono orgánico liberado por lixiviación e hidrólisis, lo cual sugiere similitud entre estos carbonos. Además, se comprobó que el nitrógeno biodisponible en el material detrítico fue usado por las bacterias para síntesis celular. Los hallazgos de este estudio indican que es viable la desnitrificación del agua subterránea usando T. angustifolia; además, aportan conocimientos relevantes sobre el uso de materiales naturales como fuentes alternativas de carbono.
Palabras claves: Desnitrificación; Typha angustifolia L.; Sustratos Sólidos Orgánicos Naturales; biorremediación, aguas subterráneas.
Abstract - Currently groundwater maintains high nitrate contamination due to increased agricultural activities. Consequently, recent research has focused on studying Natural Organic Solid Substrates (NOSS) for bioremediation of groundwater, obtaining encouraging results. However, there are still aspects that need further study, such as the supply of nutrients from the NOSS, which are essential for denitrification. To help clarify these aspects, we investigated Typha angustifolia L. (T. angustifolia) as NOSS. In this paper we present results of denitrification tests in batch reactors T. angustifolia detrital material collected in winter and summer. The release of COD by hydrolysis during winter testing (115 mg COD/day) almost doubled the value obtained in summer (60 mg COD/day). Similar yields of denitrification using organic carbon released by leaching and hydrolysis were observed, suggesting similarity between these carbons. Furthermore, it was found that the bioavailable nitrogen in the detrital material was used by bacteria for cell synthesis. The findings of this study indicate that groundwater denitrification is feasible using T. angustifolia; also they provide important insights into the use of natural materials as alternative carbon sources.
Keywords: Denitrification; Typha angustifolia L.; Natural Organic Substrate Solid; bioremediation; ground water.
Tipo de artículo: Original
Fecha de recepción: 26 de febrero de 2015
Fecha de aceptación: 12 de mayo de 2015
1. Introducción
A nivel mundial la disponibilidad de agua ha disminuido en cantidad y calidad. Esto es causado por el aumento de la población y la contaminación asociada a la agricultura intensiva y a los altos índices de aplicación de fertilizantes [1]. En los Estados Unidos, más del 75 % de los estados reportan que sus aguas subterráneas son contaminadas por actividades agrícolas; siendo el nitrato el principal contaminante [2]. Al igual que en los Estados Unidos, en Europa la principal fuente de contaminación de las aguas subterráneas se asocia a las actividades agrícolas [3]. En los países europeos el consumo de nitrógeno inorgánico alcanzó un máximo de 11 millones de toneladas anuales en la década de los 80, y aunque se ha presentado una disminución en su uso, la cantidad de toneladas en los años más recientes está en el orden de los 9 a 10 millones [4]. Este elevado consumo de fertilizantes en Europa repercute negativamente, contaminando entre 32 % y 80 % de las aguas subterráneas [3].
A raíz de esta alta contaminación con nitrato, se ha señalado la necesidad de estudiar la composición y biodisponibilidad de carbonos orgánicos para biorremediación in situ de las aguas subterráneas con bacterias desnitrificantes [3]. En este sentido, han surgido iniciativas para investigar Sustratos Sólidos Orgánicos Naturales (SSON) para la biorremediación de las aguas subterráneas, tales como paja de trigo y aserrín [5- 7]. Sin embargo, a pesar de los avances logrados en la materia, hay aspectos poco claros en el uso de SSON, tales como: liberación de carbono orgánico y el aporte de nitrógeno, en función del grado de madurez, revista_contenido lignocelulósico, de nutrientes y humedad.
Para responder estas interrogantes en este estudio se seleccionó la T. angustifolia, la cual es una gramínea diseminada en climas fríos, templados y tropicales [8], nativa de marismas, pantanos y humedales [9]. T. angustifolia es una especie de tallo robusto y hojas ensiformes que puede alcanzar hasta 3 m de altura [9]. Esta planta es usada como depuradora de aguas residuales en humedales artificiales [10, 11]. En países como Chile y Perú, tiene otros usos, tales como: material de construcción para embarcaciones artesanales; alimentos para el ganado y confección de artesanías [12]. En contraste a su amplio uso, en varias partes del mundo es considerada una especie invasiva [13-15].
Consideramos que esta investigación aporta información relevante en el uso de gramíneas, ya que son pocos los estudios que han investigado este tipo de SSON [16, 17].
2. Materiales y métodos
2.1 Colecta de T. angustifolia
Para esta investigación se usó T. angustifolia colectada en la Laguna de Batuco a 40 km al norte de la ciudad de Santiago de Chile. Las plantas se colectaron en invierno (Agosto) y verano (Febrero). En los ensayos se usó el tallo de las plantas (material detrítico), porque es donde se concentra el mayor porcentaje de carbono orgánico (como celulosa) [18].
2.2 Caracterización de material detrítico de T. angustifolia
Las muestras de los materiales detríticos fueron secadas a 105 °C por 24 horas [19]. El revista_contenido de lignina, celulosa y hemicelulosa fue obtenido usando el método de Van Soest [20]. El revista_contenido de nitrógeno se obtuvo con el método Kjeldahl y el carbono total fue obtenido por el método de combustión [19]. El nitrógeno indisponible se obtuvo según Goering & Van Soest [21]. El revista_contenido de cationes presentes en los materiales detríticos se determinó mediante digestión de ácido nítrico y detección de ICP [19]. La fracción biodegradable y carbono orgánico disponible se determinaron con la metodología propuesta por Van Soest [22].
El carbono orgánico biodisponible en los materiales detríticos fue llevado a masa de DQO, el cual se determinó siguiendo los siguientes pasos: se obtuvo el revista_contenido de celulosa de la masa seca total del material detrítico de los SSON; ii) se determinó la masa de carbono orgánico presente en la celulosa; iii) la masa de celulosa fue considerada equivalente a la masa de CH2O; iv) finalmente, al carbohidrato se le determinó la masa de electrones equivalentes de DQO.
2.3 Preparación de reactores de lixiviación
El material detrítico usado en cada ensayo fue lavado cuidadosamente para eliminar impurezas presentes en su superficie. Una vez lavado el material, se seccionaron en trozos de 1 cm; luego se irradiaron con luz ultravioleta para su desinfección. Se usó luz ultravioleta, porque es un método de desinfección eficaz usado para reducir poblaciones microbianas presentes en la superficie de los vegetales [23]. Se emplearon lámparas de efecto germicida, cuya longitud de onda estaba entre los 245 nm y 345 nm. La dosis aplicada fue de 1.2 KJ/m2 por un período de 10 minutos. Esta dosis ha sido reportada como efectiva para abatir las poblaciones microbianas de las superficies de materiales vegetales [24].
El agua y las botellas usadas en los ensayos fueron esterilizadas. Los reactores se prepararon por triplicado en una campana de flujo laminar. En el ensayo se usaron agitadores termo-regulados para mantener la temperatura en los reactores a 30 ± 2 °C y agitados a 150 rpm. El volumen total usado en los ensayos fue 500 mL (agua + material detrítico húmedo). La masa húmeda de material detrítico de T. angustifolia usada en cada reactor fue de 40.7 g. Los volúmenes de agua en los reactores de invierno y verano con T. angustifolia fueron 417 mL y 456 mL, respectivamente. Esta diferencia en el volumen de agua se debió a las densidades de los materiales detríticos.
2.4 Configuración de reactores biológicos
Los ensayos consistieron de reactores batch con un volumen total 2 L (agua + material detrítico húmedo). La relación agua - material detrítico fue de 1/6 para el ensayo de invierno, según lo realizado por Gibert et al. [25]. La masa usada de T. angustifolia fue 163 g. Para el ensayo de verano se usó la misma masa húmeda. Por lo tanto, el volumen de agua usada en los reactores de invierno y verano fueron 1667 ml y 1810 ml, respectivamente.
Los reactores se cubrieron con papel aluminio para impedir la entrada de la luz solar. En cada ensayo se utilizó agua desionizada y se dosificó una concentración de nitrato de 100 mg N-NO3-/l, usando NaNO3. Los reactores se operaron en rangos de pH entre 6.5 y 7.5; para ello se dosificaron buffer de fosfato (3 g/L de KH2PO4 y 3 g/L K2HPO4). Se inyectó nitrógeno gaseoso de 5 a 10 minutos para desairar los reactores batch y así mantener condiciones anóxicas. Los reactores se operaron con agitación continua de 150 rpm y a una temperatura de 30 ± 2 °C, usando agitadores termo-regulados.
Los materiales detríticos de T. angustifolia fueron usados sin previo tratamiento, es decir que se mantuvo su revista_contenido de humedad inicial, para propiciar condiciones naturales. En estudios similares, el material detrítico de gramíneas fue deshidratado [26]. Los materiales detríticos de T. angustifolia no fueron lavados ni irradiados con luz ultravioleta como se hizo en los ensayos de lixiviación; de esta forma se permitió el crecimiento de las bacterias nativas adheridas a estos SSON.
El uso de bacterias nativas adheridas a SSON ha sido reportado [16, 25]. Además, no se dosificaron micronutrientes en los reactores batch biológicos, ya que se asumió que las bacterias los obtendrían de los materiales detríticos.
Es importante señalar que se adoptó la DQO como la medida de referencia para el carbono orgánico medido directamente en el agua, aquel usado en la reducción de nitrato y para representar el carbono orgánico liberado desde los SSON. Esto fue adoptado porque está demostrado que la DQO es el más simple y fácil de los parámetros individuales usados para describir la concentración de desechos o aguas residuales, en términos de mg O2/L [27]. Además, es la única medida que permite relacionar los equivalentes de electrones de sustrato orgánico, biomasa activa y el oxígeno utilizado [28]. De esta forma es posible hacer balances de masas de carbono orgánico entre el medio acuoso y los SSON.
En este artículo se usarán los términos de carbono orgánico y DQO, para representar biomasa biodisponible en los materiales detríticos y el donante de electrones o sustrato orgánico.
3. Resultados
3.1 Caracterización de material detrítico
Las colectas de T. angustifolia se realizaron en dos estaciones del año (invierno y verano), con el propósito de evaluar la variabilidad del revista_contenido de nutrientes y el grado de madurez (tabla 1). Los resultados obtenidos, reflejan que la planta cosechada en invierno registró un mayor revista_contenido de nutrientes (por ejemplo, nitrógeno). En cuanto a los revista_contenidos de elementos inorgánicos, se encontró poca variación en ambos períodos. Un factor común identificado entre los materiales detríticos fue el alto revista_contenido de sales, siendo el Sodio el de mayor valor (Tabla 1).
Tabla 1. Características físico-químicas de materiales detríticos de T. angustifolia colectadas en verano e invierno
3.2 Ensayos de Lixiviación
En los ensayos de lixiviación se encontró que las concentraciones de nitrato, nitrito y amonio en el sobrenadante de reactores de invierno fueron 1.78 mg N-NO3 -/g sust, 0.08 mg N-NO2 -/gsust y 1.1 mg N-NH4 +/gsust, respectivamente (tabla 2). Para el ensayo de verano no se detectaron nitrato ni nitrito, mientras que el revista_contenido de amonio en el sobrenadante fue 0.01 mg N-NH4 +/gsust. Los resultados de DQO en los ensayos de lixiviación fueron altos, principalmente en los reactores con T. angustifolia de invierno (tabla 2).
Tabla 2. Masa de nitrógeno, DQO y otros elementos lixiviados por gramo de masa seca de T. angustifolia.
3.3. Ensayos batch biológicos
3.3.1.Comportamiento de componentes nitrogenados en sobrenadantes
Nitrato
Durante la operación de los reactores batch se dosificó de nitrato cada 2 o 3 días, para obtener una concentración de 100 mg N-NO3 -/L. El nitrato se consumió totalmente y se mantuvo el mismo comportamiento durante los períodos de operación de los reactores (figura 1a y 1b). La única diferencia encontrada en los ensayos se registró en los primeros 7 días de operación de los reactores de invierno, lo cual se atribuye a la adaptación de bacterias y a la liberación de nitrato desde T. angustifolia, debido a la lixiviación.
Figura 1. a) Las mediciones de nitrato en los ensayos de invierno reflejaron una completa desnitrificación b). En los ensayos de invierno se observó una remoción de nitrato por arriba 90 % ( ![]() dosificación de nitrato).
dosificación de nitrato).
Nitrito
En el ensayo de invierno se registraron altos valores de nitrito en los primeros días de operación y posterior al día ocho la concentración estuvo menor a 0.3 mg N-NO2 /L. En tanto, la concentración de nitrito fue casi cero en los ensayos de verano (figura 2).
Figura 2. Resultados de nitrito en el sobrenadante de los reactores de invierno y verano. El nitrito del ensayo de invierno pudo ser el resultado de una desnitrificación parcial.
Amonio
Los resultados de amonio en el sobrenadante reflejaron un comportamiento similar durante la operación de los reactores batch, ya que los máximos valores se obtuvieron en el sexto día de operación (figura 3). Las concentraciones máximas de amonio en los ensayos de invierno y verano fueron 23.8 ± 2.45 mg N-NH +/L y 39.5 ± 2.25 mg N-NH4 +/L, respectivamente. Posterior al sexto día, se registró una disminución del amonio en el sobrenadante de los reactores, hasta llegar a valores menores a 3 mg N-NH4+/L.
Figura 3. El comportamiento de la liberación de amonio desde T. angustifolia fue similar en los reactores batch de invierno y verano.
3.3.2. Balance de masa de nitrógeno en T. angustifolia
El balance de nitrógeno en el material detrítico se hizo en porcentaje de masa seca. Para ello se determinó el revista_contenido de nitrógeno total antes y después de los ensayos; de igual manera, se determinó el nitrógeno no disponible. El nitrógeno no disponible es aquel que se encuentra entrelazado con lignina, la cual que no es hidrolizable por bacterias [21].
La masa de nitrógeno total presente en los materiales detríticos de T. angustifolia de invierno antes y después de los ensayos fueron 247 mg N y 139 mg N, respectivamente (tabla 3). Al restar estos dos valores se encontró que el nitrógeno liberado durante los ensayos fue 108 mg N. Esta masa representa el 68 % del nitrógeno biodisponible en la T. angustifolia de invierno. En los ensayos con T. angustifolia de verano, la masa de nitrógeno fue de 401 mg N antes del ensayo y 300 mg N al finalizar las pruebas. Esto indica que durante la operación de los reactores batch se liberó una masa de nitrógeno de 101 mg N. Esto corresponde al 97 % del nitrógeno biodisponible en el material detrítico de T. angustifolia.
Tabla 3. Balance de nitrógeno en materiales detríticos de T. angustifolia
3.3.3. Comportamiento de DQO en el sobrenadante
Los resultados DQO muestran que las máximas masas para los ensayos de invierno y verano se registraron al cuarto y sexto día de operación de los reactores, respectivamente (figura 4a). En el ensayo de invierno la máxima masa de DQO fue 1342 mg y en verano fue de 3059 mg (figura 4a). Desde el octavo día, la DQO disminuyó progresivamente hasta el final del ensayo. En estos ensayos se observó que el decrecimiento fue de tipo lineal (figura 4b).
Figura 4. a) La masa de DQO del ensayo de verano fue mayor que el liberado en el ensayo de invierno; b) El comportamiento de la disminución de la DQO entre el día 8 y 29 fue similar en los ensayos de invierno y verano.
El comportamiento de la liberación de DQO total acumulado en el sobrenadante se presenta en la figura 5. Estos resultados se obtuvieron de sumar los valores de DQO medidos en el sobrenadante de los reactores y la DQO equivalente usada en la reducción de nitrato. La DQO equivalente se obtuvo de multiplicar el nitrato reducido, por el factor estequiométrico 2.225 mg DQO/mg N-NO3 [16]. La liberación de DQO desde material detrítico de T. angustifolia de invierno y verano fue similar hacia el final de los ensayos (figura 5).
Figura 5. DQO acumulado en el sobrenadante de los reactores batch para los ensayos de invierno y verano tendieron a ser similares hacia el final de los ensayos.
3.3.4. Balance de masa de carbono orgánico (como DQO) en sobrenadante y materiales detríticos
Se realizó un balance de DQO en el sobrenadante de los reactores batch, para definir cuánto se liberó debido a lixiviación y a hidrólisis. En los ensayos de invierno se identificó que 2.2 g de DQO se debió a lixiviación y 2.4 g de DQO se atribuye a hidrólisis; mientras que en verano, la masa de DQO por lixiviación e hidrólisis fueron 4.1 g y 1.5 g, respectivamente (tabla 4).
Tabla 4. Balance de masa de DQO presente en el sobrenadante de los reactores y en los materiales detríticos de T. angustifolia colectadas en invierno y verano
3.3.5. Relación C/N en sobrenadante
Las relaciones C/N para los ensayos de invierno y verano se determinaron con la DQO medida y el nitrato dosificado. Para el ensayo de invierno la relación C/N promedio fue de 5.1, con un valor máximo de 7.2. En tanto, el valor promedio y máximo de C/N para el ensayo de verano fue 12.4 y 9.6, respectivamente (Figura 6).
Tiempo (Días)
Figura 6. Relación C/N en el sobrenadante de reactores batch con T. angustifolia de invierno y verano estuvieron cercanos a los valores estequiométricos.
4. Discusión
4.1 Propiedades físicas y químicas de materiales detríticos
Los resultados de caracterización del material detrítico presenta que la T. angustifolia de invierno presentó un mayor revista_contenido de nitrógeno lo cual se refleja en una menor relación C/N, así como un menor porcentaje lignocelulósico (tabla 1). Estos resultados son concordantes con estudios de consumo y almacenamiento de nutrientes en la T. angustifolia [30-32]. En tanto, el material detrítico de T. angustifolia de verano mostró una estructura más robusta y fuerte, lo que indica que la planta estaba más desarrollada. Este grado de madurez se debió a la alta actividad vegetativa de la planta en donde hay floración, la cual se presenta en los meses calurosos del año. Ratushnyak [33] señala que T. angustifolia produce mayor cantidad de carbohidratos como Fructuosa, Glucosa y Maltosa durante el verano.
En base a estos resultados, se infiere que T. angustifolia de invierno se degradaría con mayor rapidez. La biodegradabilidad de un material detrítico disminuye según el grado de madurez, lo cual está relacionado con el revista_contenido lignocelulósico [18]. La degradación se presenta más rápido por tener un menor porcentaje de lignina, facilitando a las bacterias obtener el carbono orgánico [29]. De igual forma, la relación C/N juega un papel importante en la degradación de los materiales detríticos, ya que las plantas que presentan una menor relación de C/N contienen más nitrógeno disponible para las bacterias para su síntesis celular y por ende el tiempo de biodegradación estos materiales será menor [18].
4.2 Compuestos solubles liberados en ensayos de lixiviación
Para tener claridad de la liberación de compuestos solubles debido a lixiviación desde materiales detríticos de T. angustifolia, se aplicó el método de desinfección con irradiación UV, con el objetivo de abatir las poblaciones microbianas presentes en la corteza de los materiales detríticos usados en la investigación. En este caso, se quería demostrar cuánto sustrato soluble se liberaba en la fase abiótica, es decir por lixiviación. De igual forma, la supervivencia de alguna población microbiana a la irradiación de luz UV no alteró el ensayo, ya que las condiciones del sistema no favorecieron el desarrollo de las bacterias. Estas condiciones corresponden a la ausencia de aceptor de electrones externos (nitrato u oxígeno), necesarios para que ocurra la degradación biológica de materiales orgánicos [18, 27].
Para los ensayos de lixiviación con material detrítico colectado en invierno, los resultados de los compuestos nitrogenados en el sobrenadante concuerdan con la caracterización del material detrítico de invierno, el cual presentó el mayor porcentaje de nitrógeno (tabla 1). En tanto, en los ensayos de verano, el aporte fue menor (tabla 1). Asaeda et al. [30], señalan que la T. angustifolia acumula nutrientes en la época de crecimiento, la cual se presenta en los meses del año con menores temperaturas.
A pesar que el amonio es la primera opción como fuente de nitrógeno de las bacterias para su síntesis celular, su acumulación en el agua es desfavorable, principalmente si la T. angustifolia es usada como sustrato en la remoción de nitrato del agua potable. En tanto, la liberación de nitrato y nitrito soluble durante la lixiviación también es desfavorable para un proceso de desnitrificación, porque estos iones son precisamente los que se requiere remover del agua. Zhangetal.[6], detectaron liberación de compuestos nitrogenados (N-NO3-, N-NO2- y N-NH4+) usando paja de trigo, lo cual lo consideran una limitación en la remediación del agua subterránea.
La liberación de DQO por gramo de material detrítico en los ensayos de invierno fue 3.3 veces mayor que los obtenidos en los ensayos de verano. La menor liberación de DQO por gramo de material detrítico en los ensayos de verano está relacionada con su menor revista_contenido de humedad. También se puede destacar que en la lixiviación hubo altas concentraciones de Sodio y Potasio, principalmente en los reactores que contenían T. angustifolia de invierno (Tabla 2). La masa de Potasio liberada en los ensayos de invierno fue 9 veces mayor que el registrado en verano; mientras que el sodio fue 35 veces mayor. Basados en estos resultados, se sugiere precaución al momento de usar T. angustifolia; principalmente aquel material colectado en meses fríos del año, debido a los altos aportes de nitrógeno, carbono soluble y sales.
4.3 Ensayos batch biológicos
En estos ensayos se evaluó tanto la lixiviación como la hidrólisis. Estos ensayos se denominaron biológicos porque hubo participación de bacterias. Se consideró que las bacterias fueron responsables de la liberación del carbono orgánico por varios aspectos: i) que el pH mantenido en los microambientes de los reactores batch, estuvo entre 7 y 8; el cual es el rango de pH donde mejor se desempeñan las bacterias [34]; ii) además, en los ensayos se mantuvieron condiciones anóxicas, y según la literatura en los procesos de ruptura de componentes orgánicos, donde el aceptor de electrones es nitrato, los grupos de microorganimos que intervienen son bacterias [18]. En estudios similares al nuestro se encontró que el biofilm que creció sobre los SSON estaba constituido por bacterias [35, 36].
4.3.1 Comportamientos de componentes nitrogenados en sobrenadante de reactores biológicos
Las máximas tasas de desnitrificación obtenidas para los ensayos de invierno y verano fueron 50 N-NO3- /L.d y 45.25 mg N-NO3- /L.d, respectivamente. La similitud entre las tasas de desnitrificación obtenidos en estos ensayos sugieren que las concentraciones de micronutrientes requeridas por las bacterias para su actividad metabólica se obtuvieron del material detrítico, y que el carbono orgánico liberado fue similar en ambas pruebas, mostrando que hubo la concentración necesaria del donante de electrones. Unacaracterísticaadestacarenestosensayosfueque la remoción de nitrato estuvo entre 90 y 100 %, a pesar de las altas concentraciones de sales liberadas del material detrítico de T. angustifolia. En la literatura han reportado desnitrificación en tratamiento de aguas residuales con altos revista_contenidos de sal [37]. Por lo tanto, se puede señalar que T. angustifolia es una fuente potencial de carbono orgánico, para usarlo en la remoción biológica de nitrato.
La presencia de nitrito en el ensayo de invierno se asocia a una desnitrificación incompleta, causada por la poca adaptación de las bacterias durante los primeros días de operación de los reactores. Esta condición también fue observada en ensayos preliminares (datos no mostrados). No se considera el oxígeno disuelto como causa de la presencia de nitrito, ya que este parámetro se mantuvo por debajo de 1 mg O2/L.
En cuanto al amonio, se encontró que en invierno el aporte fue de 1.95 mg N-NH4+ /gsust, siendo cuatro veces mayor al amonio aportado en los ensayos de verano (0.45 mg N-NH4+ /gsust). La variación en el comportamiento del amonio en los ensayos con T. angustifolia se asocia a varios factores: (i) que se usó un valor constante de nitrato (100 mg N-NO3-/L), lo cual generó una condición estable; (ii) además, hubo una liberación de amonio desde el material detrítico de T. angustifolia hasta un valor máximo y luego fue consumido por las bacterias. Esta presencia de amonio se debió a lixiviación y la hidrólisis de proteínas.
La hidrólisis de proteínas se consideró la principal responsable de la presencia de amonio, ya que se aportó el doble de la fase de lixiviación (tabla 3). En la biodegradación de materiales detríticos, las proteínas son las primeras en ser hidrolizadas por bacterias [18]. Vavilin et al. [38], señalan que durante la degradación de proteínas se libera nitrógeno en forma de amonio. La presencia de amonio asociado a hidrolización de proteínas ha sido reportada en la desnitrificación usando SSON como chitina [39] y granos de madera [40]. Sin embargo, otros investigadores señalan que la presencia de amonio en sistemas desnitrificantes es causada probablemente por la Reducción Desasimilatoria de Nitrato a Amonio (RDNA) [6, 25, 41]. Sin embargo, para que dicha ruta de reducción de nitrato a amonio se presente, la relación C/N en el agua debe ser mayor al valor estequiométrico [42].
En nuestro estudio se descarta que la RDNAfuera la ruta formadora de amonio, dado que el valor promedio de la relación C/N en el sobrenadante de los reactores está cercano al valor estequiométrico (figura 6). Deago & Pizarro [16] señalan que el factor estequiométrico de la relación C/N es de 6.11, para la desnitrificación usando SSON como fuente de carbono orgánico y nitrógeno (como amonio) para síntesis celular. De hecho, Cuervo-Lopez et al [42], han reportaron desnitrificación en sistemas de tratamiento con valores de C/N cercanos a 34.
En el caso de usar T. angustifolia como SSON para biorremediación in situ, es decir en barreras permeables reactivas, como ha sido propuesto en investigaciones similares [25, 43], es posible que la ruta de la reducción de nitrato sea a amonio; dado que se ha encontrado flora microbiana en el suelo capaz de realizar esta ruta reductora de nitrato [44]. En estos casos, el amonio debido a RDNA podría ser favorable para plantas y microorganismos de ecosistemas con escaso revista_contenido de nitrógeno [44].
4.3.2 Balance de masa de nitrógeno en materiales detríticos
Según el balance de masa de nitrógeno, 97 % del nitrógeno biodisponible de los materiales detríticos de T. angustifolia de verano fue consumido, mientras que en invierno se usó el 68 % del nitrógeno biodisponible (tabla 3). Los resultados indican que las bacterias hidrolizaron proteínas presentes en el material detrítico y obtuvieron el nitrógeno para su síntesis celular. El consumo de nitrógeno fue similar en ambos ensayos, con 108 mg N en invierno y 101 mg N en verano, lo que indica que la adaptación de las bacterias al microambiente de los reactores fue favorable. Sin embargo, se observa que al final de los ensayos de invierno quedaron disponibles 51 mg de N en el material detrítico, mientras que en verano solo 3 mg (figura 7). El nitrógeno biodisponible en T. angustifolia de verano se agotó con mayor rapidez, debido a su menor revista_contenido inicial (figura 7). Esta condición sugiere que una vez agotado el nitrógeno de los materiales detríticos, las bacterias usarían nitrato como su fuente de nitrógeno para síntesis celular.
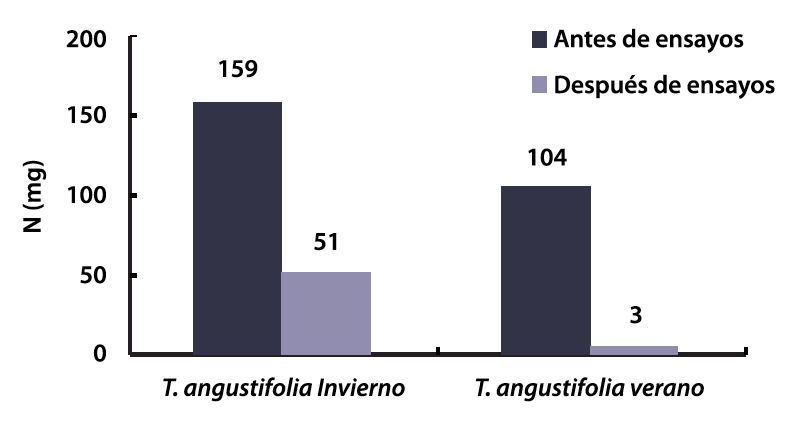
Figura 7. revista_contenido >de nitrógeno en materiales detríticos antes y después de ensayos.
4.3.3. Comportamiento de liberación de DQO
Como se describió previamente, la liberación de DQO desde T. angustifolia fue identificada en dos fases: física y biológica. La fase física corresponde a lixiviación de compuestos soluble causada por la autolisis [18] y la fase biológica está asociada a la actividad hidrolítica de bacterias en crecimiento adherido [18, 27, 38]. La fase física o de lixiviación se presentó en los primeros 8 días (figuras 4a). En esta fase la liberación de DQO fue alta. En la segunda fase se refleja una alta actividad bacteriana, dado que se incrementó el consumo de carbono soluble en el sobrenadante de los reactores batch (figura 4b). El comportamiento lineal de la disminución de DQO en el sobrenadante fue mayor en los reactores que contenían mayor masa de material detrítico. Esto se observó en los reactores con T. angustifolia de verano, donde la pendiente de consumo de DQO en el sobrenadante del reactor de verano fue 2.6 veces mayor que en invierno (figura 4b).
La adaptación de las bacterias al microambiente de los reactores batch, es atribuida al tipo de carbono orgánico lixiviado. Smith [45] indica que el carbono soluble lixiviado es de alta calidad y es responsable de promover el crecimiento y la actividad microbiana. Esta actividad microbiana fomenta la colonización de los sustratos sólidos, el cual es un paso obligado para la solubilización de productos que benefician a otros microorganismos [46].
El buen rendimiento observado en este estudio, posterior al día 8 (fase biológica), nos indica que las bacterias hidrolizaron carbonos orgánicos similares al liberado por lixiviación. Moran & Hodson [47], reportaron similitudes entre el carbono orgánico soluble liberado por lixiviación y el obtenido por hidrólisis del revista_contenido lignocelulósico. Una vez agotado el carbono orgánico soluble, el siguiente paso en el proceso de biodegradación es el ataque de la celulosa [48]. Moran et al. [49], indican que la celulosa es el primer carbono estructural del material detrítico en ser degradado por microorganismos. Esta degradación se debe a la acción de las enzimas de bacterias hidrolíticas, las cuales rompen los enlaces covalentes que mantienen unidas las moléculas de glucosa [34]. Esta glucosa puede ser asimilada directamente por las bacterias desnitrificantes [18].
El siguiente esquema resume los procesos que intervienen en la liberación de carbono orgánico desde materiales detríticos y su uso en la desnitrificación del agua (figura 8).
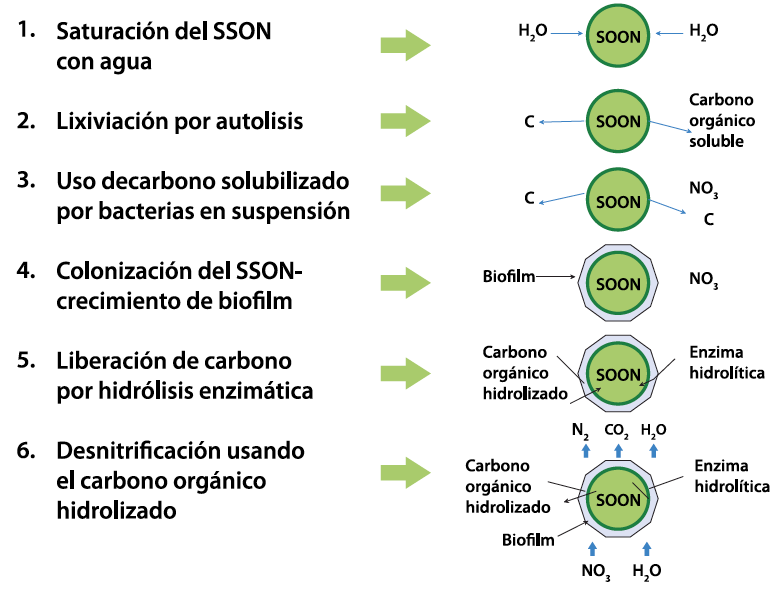
Figura 8. Esquema conceptual de la liberación de carbono orgánico desde SSON y su uso en la desnitrificación.
Aunque se ha identificado que la fase de lixiviación ayuda a la aclimatación de bacterias, el exceso de liberación de carbono orgánico es una condición no deseada. Esta fase de lixiviación está en función de: i) el área de contacto del SSON por donde ingresa el agua; ii) a la concentración de los carbonos orgánicos solubles presente en las vacuolas de las células vegetales; iii) y estos orgánicos solubles dependen de la madurez o edad de la planta. Por lo tanto, se reitera que la lixiviación es una etapa importante a considerar en la desnitrificación usando T. angustifolia como fuente de carbono orgánico.
Como se observaron comportamientos similares del consumo de carbono a lo largo de los ensayos, se considera que la hidrólisis es el último proceso de biodegradación de materiales detríticos. Esto se debió a las condiciones anóxicas mantenidas durante las pruebas. Angelidaki & Sander [27] señalan que la degradación en condiciones anóxicas depende de la disponibilidad de aceptor de electrones como nitrato.
De los resultados obtenidos en los ensayos batch (figura 5), estimamos las tasas de liberación de DQO debido a lixiviación e hidrólisis (tabla 5).
Tabla 5. Comportamiento de la liberación de la masa de DQO desde T. angustifolia en cada ensayo batch.
La mayor tasa de liberación de DQO por lixiviación se presentó en verano, lo cual se debió a altas concentraciones de sustratos solubles fácilmente asimilables presentes en el material detrítico de T. angustifolia; mientras que la tasa de liberación de DQO debido a hidrólisis fue mayor en invierno, dado que el material detrítico de T. angustifolia usado contenía menor porcentaje de lignina. Estos resultados nos muestran que en términos prácticos, es más favorable usar T. angustifolia colectada en verano, porque aumenta el tiempo de degradación y por ende su vida útil.
4.3.4 Balance de masa de DQO en materiales detríticos y sobrenadante
En los ensayos de invierno, 48 % de DQO liberado al sobrenadante se asocia a lixiviación (112.5 mg DQO/gsust) y 52 % corresponde a hidrólisis (124.21 mg DQO/gsust); mientras que en verano, 71 % se atribuye a lixiviación (27.6 mg DQO/gsust)y 29 % a hidrólisis (10.7 mg DQO/ gsust). Para los ensayos de invierno se aprecia que hubo un aporte similar de las masas de carbono por lixiviación y por hidrólisis; sin embargo, en los ensayos de verano 2/3 del carbono liberado se debe a lixiviación. La disparidad en las proporciones de DQO liberada por lixiviación está asociada a las concentraciones de carbono orgánico soluble presentes en los materiales detríticos, donde 15.3 g DQO/L se obtuvo en los materiales de invierno y 278 g DQO/L para verano. En cuanto a la DQO liberada por hidrólisis, se encontró que en invierno se usó 34 % del carbono estructural biodisponible (como celulosa) en el material detrítico; mientras que en el ensayo de verano se usó solo 2.2 %. Esta diferencia en la liberación de carbono por hidrólisis se asocia a varios factores: i) la alta disponibilidad de DQO soluble en el sobrenadante de los reactores al inicio de los ensayos (debido a lixiviación) aportado en los ensayos de verano; ii) y que la masa de T. angustifolia de verano fue aproximadamente 8 veces mayor a la masa seca de T. angustifolia de invierno.
Los resultados confirman lo señalado en la literatura, la cual indica que en la época de verano las plantas producen mayor cantidad de carbono soluble, debido a una alta actividad vegetativa de las plantas [33, 50]. Ratushnyak [33], señala que en la época de alta actividad vegetativa, los carbohidratos son los principales carbonos orgánicos producidos por T. angustifolia. Esto también confirma el supuesto sobre la similitud en el tipo de carbono orgánico liberado durante las fases de lixiviación y biológica.
La capacidad que tienen las bacterias de aprovechar los SSON como soporte para su crecimiento, fuente carbono orgánico, nitrógeno y otros nutrientes, hacen que los sistemas desnitrificantes sean más simples y autosuficientes que aquellos que requieren dosificación de sustratos solubles.
5. Conclusiones
En este estudio se evaluó el comportamiento de la liberación de carbono orgánico y nutrientes desde material detrítico de T. angustifolia, colectados en diferentes épocas del año. Se identificó que el aporte de carbono y nutrientes se debió a lixiviación (por autolisis) y a hidrólisis enzimática. La liberación de carbono y nutrientes estuvieron regulados por el revista_contenido de humedad, densidad y área superficial del material detrítico. Se encontró que T. angustifolia colectada en verano, aportó mayor masa de carbono orgánico por gramo de material y se confirmó que el amonio medido en el sobrenadante de los reactores batch procedía de los materiales detríticos de T. angustifolia. Este amonio fue la fuente de nitrógeno para síntesis celular de las bacterias.
Para el mejor aprovechamiento de T. angustifolia se recomienda que su colecta sea en verano, dado que la planta contará con mayor grado de madurez. Propiedades como la relación C/N, el revista_contenido lignocelulósico y la densidad serán mayores, haciendo más lenta la degradación del material y en consecuencia tendrá una mayor vida útil; además, es más recomendable usar materiales detríticos con mayor grado de madurez, dada su alta actividad vegetativa, en donde la planta genera sustratos solubles fácilmente asimilables por bacterias desnitrificantes en altas concentraciones.
Los hallazgos de esta investigación aportan información relevante que permite considerar la T. angustifolia como potencial SSON para biorremediación del agua subterránea contaminada con nitrato.
6. Agradecimientos
Expresamos nuestro agradecimiento al Gobierno de la República de Panamá por financiar nuestros estudios doctorales, mediante el Programa de Becas de Excelencia Profesional SENACYT-IFARHU 2006-2010, de la cual es producto esta investigación.
Referencias Bibliográficas
1. Chambon, P., et al., WHO Guidelines for drinking-water quality: volume 2. Health Criteria and Other Supporting Information - Addendum. 1998, World Health Organization: Geneva, Switzerland. p. 1-127.
2. Ongley, E.D. Lucha Contra la Contaminación Agrícola de los Recursos Hídricos. (Estudio FAO Riego y Drenaje - 55). 1997; Available from: http://www.fao.org/docrep/W2598S/ w2598s00.htm#Contents.
3. Rivett, M.O., et al., Nitrate attenuation in groundwater: A review of biogeochemical controlling processes. Water Research, 2008. 42(16): p. 4215-4232.
4. CCE, INFORME DE LA COMISION: aplicación de la Directiva 91/676/CEE del Consejo relativa a la protección de las aguas contra la contaminación producida por nitratos utilizados en la agricultura, in COM(2002) 407 final 2002: Bruselas.
5. Wang, X.M. and J.L. Wang, Nitrate removal from groundwater using solid-phase denitrification process without inoculating with external microorganisms. International Journal of Environmental Science and Technology, 2013. 10(5): p. 955-960.
6. Zhang, J.M., et al., Behavior of solid carbon sources for biological denitrification in groundwater remediation. Water Science and Technology, 2012. 65(9): p. 1696-1704.
7. Fan, Z.X., J. Hu, and J.L. Wang, Biological nitrate removal using wheat straw and PLA as substrate. Environmental Technology, 2012. 33(21): p. 2369-2374.
8. Asaeda, T., et al., Latitudinal characteristics of below- and above- ground biomass of Typha: A modelling approach. Annals of Botany, 2005. 96(2): p. 299-312.
9. Earl, J.S. Typha angustifolia. Narrow Leaf Cattail. 2004; Available from: http://www.rook.org/earl/bwca/nature/aquatics/ typhaan.html.
10. Firdaus e, B. and S. Khilji, Bioaccumulation of metals from tannery sludge by Typha angustifolia L. African Journal Of Biotechnology, 2008. 7(18): p. 3314-3320.
11. Nilratnisakorn, S., P. Thiravetyan, and W. Nakbanpote, Synthetic reactive dye wastewater treatment by narrow-leaved cattails (Typha angustifolia Linn.): Effects of dye, salinity and metals. Science Of The Total Environment, 2007. 384(1-3): p. 67-76.
12. Artes, C.N.d.l.C.y.l. Museo Campesino y de los antiguos oficios. 2013 [cited 2013 March].
13. Hood, W.G., Applying and testing a predictive vegetation model to management of the invasive cattail, Typha angustifolia L., in an oligohaline tidal marsh reveals priority effects caused by non- stationarity. Wetlands Ecology and Management, 2013. 21(4): p. 229-242.
14. Miklovic, S., Typha angustifolia Management: Implications for Glacial March Restoracion. Student On-Line Journal, 2000. 6(2): p. 11.
15. Shih, J.G. and S.A. Finkelstein, Range dynamics and invasive tendencies in Typha latifolia and Typha angustifolia in Eastern North America derived from herbarium and pollen records. Wetlands, 2008. 28(1): p. 1-16.
16. Deago, E.M. and G.E. Pizarro, Denitrification of drinking water using Saccharum spontaneum L. as a natural organic solid substrate. Journal of Water Supply Research and Technology-Aqua, 2013. 62(7): p. 477-486.
17. Ovez, B., S. Ozgen, and M. Yuksel, Biological denitrification in drinking water using Glycyrrhiza glabra and Arunda donax as the carbon source. Process Biochemistry, 2006. 41(7): p. 1539- 1544.
18. Reddy, K.R. and R.D. DeLaune, Biogeochemestry of Wetlands: Science and Applications. First ed. Vol. 1. 2008, Florida: Taylor & Francis Group. 774.
19. APHA, AWWA, and WEF, Standar Methods for The Examination of Water And Wastewater. 21 ed, ed. A.D. Eaton, et al. 2005, Baltimore, Meryland.
20. Van Soest, P.J., Use of detergents in the analysis of fibrous feeds. II. A rapid method for determination of fiber and lignin. Journal Association Official Agronomy Chemistry, 1963. 46: p. 829-835.
21. Goering, H.K. and P.J. Va Soest, Forage fiber analysis (aparatus, reagent, procedures, and some applications). Agriculture Handbook No 379, ed. A.R.S.-U.S.D.o. Agriculture. 1970, Washington, D. C.
22. Van Soest, P.J., Environmental and forage quality, in Nutrition Conferences for Feed Manufactures. 1996: Rochester, Ithaca, NY.
23. Allende, A. and F. Artes, UV-C radiation as a novel technique for keeping quality of fresh processed 'Lollo Rosso' lettuce. Food Research International, 2003. 36(7): p. 739-746.
24. Aguayo, E., et al., Técnicas emergentes y sostenibles para la desinfección de frutas y hortalizas mínimamente procesadas, in 17° Sympoaium Internacional-Tecnologías y Sanidad de las frutas y hortalizas en postcosecha. 2007: Valencia, España.
25. Gibert, O., et al., Selection of organic substrates as potential reactive materials for use in a denitrification permeable reactive barrier (PRB). Bioresource Technology, 2008. 99(16): p. 7587-7596.
26. Ovez, B., Batch biological denitrification using Arundo donax, Glycyrrhiza glabra, and Gracilaria verrucosa as carbon source. Process Biochemistry, 2006. 41(6): p. 1289-1295.
27. Angelidaki, I. and W. Sanders, Assessment of anaerobic biodegrability of macropollutants. Reviews Enviromental Science and Bio/Technology, 2004. 3(2): p. 117-129.
28. Cokgor, E.U., et al., Respirometric analysis of activated sludge behaviour - I. Assessment of the readily biodegradable substrate. Water Research, 1998. 32(2): p. 461-475.
29. Chandler, J.A., et al., Predicting methane fermentation biodegradability, in Biotechnology And Bioengineering. 1980. p. 93- 107.
30. Asaeda, T., P. Sharma, and L. Rajapakse, Seasonal patternsof carbohydrate translocation and synthesis of structural carbon components in Typha angustifolia. Hydrobiologia, 2008. 607: p. 87-101.
31. Sharma, P., et al., Morphology, growth and carbohydrate storage of the plant Typha angustifolia at different water depths. Chemistry And Ecology, 2008. 24(2): p. 133-145.
32. Das, S.C. and N. Tanaka, Estimating nitrogen budgets of Typha angustifolia by considering the regrowth shoot productivity and nitrogen content after harvesting aerial organs in different growing seasons Landscape and Ecological Engineering, 2007: p. 99-108.
33. Ratushnyak, A.A., The investigation of exometabolism of some aquatic macrophytes. Global Journal of Enviroemental Research, 2008. 2(2): p. 92-95.
34. Howard, R.L., et al., Lignocellulose biotechnology: issues of bioconversion and enzyme production. African Journal of Biotechnology, 2003. 2(12): p. 602-619.
35. Ovez, B., J. Mergaert, and M. Saglam, Biological denitrification in drinking water treatment using the seaweed Gracilaria verrucosa as carbon source and biofilm carrier. Water Environment Research, 2006. 78(4): p. 430-434.
36. Shen, Z.Q., et al., Denitrification performance and microbial diversity in a packed-bed bioreactor using biodegradable polymer as carbon source and biofilm support. Journal of Hazardous Materials, 2013. 250: p. 431-438.
37. Foglar, L., L. Sipos, and N. Bolf, Nitrate removal with bacterial cells attached to quartz sand and zeolite from salty wastewaters. World Journal of Microbiology & Biotechnology, 2007. 23(11): p. 1595-1603.
38. Vavilin, V.A., et al., Hydrolysis kinetics in anaerobic degradation of particulate organic material: An overview. Waste Management, 2008. 28(6): p. 941-953.
39. Robinson-Lora, M.A. and R.A. Brennan, The use of crab- shell chitin for biological denitrification: Batch and column tests. Bioresource Technology, 2009. 100(2): p. 534-541.
40. Shen, Z.Q. and J.L. Wang, Biological denitrification using cross- linked starch/PCL blends as solid carbon source and biofilm carrier. Bioresource Technology, 2011. 102(19): p. 8835-8838.
41. Cuervo-López, F., et al., Principles of denitrifying processes, in Environmental Technologies to Treat Nitrogen Pollution: Principles and Engineering, F. Cervantes, Editor. 2009, IWA Publishing: London. p. 420.
42. Robertson, W.D., et al., Long-term performance of in situ reactive barriers for nitrate remediation. Ground Water, 2000. 38(5): p. 689- 695.
43. Rutting, T., et al., Assessment of the importance of dissimilatory nitrate reduction to ammonium for the terrestrial nitrogen cycle. Biogeosciences, 2011. 8(7): p. 1779-1791.
44. Smith, J.L., Cycling of nitrogen throubg microbial activity, in Soil Biology: Effects on Soil Quality, B.A.S. J. L. Hatfield, Editor. 1994, Lewis: Boca Raton, Florida, U.S.A. p. 91-120.
45. Vavilin, V.A., S.V. Rytov, and L.Y. Lokshina, A description of hydrolysis kinetics in anaerobic degradation of particulate organic matter. Bioresource Technology, 1996. 56(2-3): p. 229-237.
46. Moran, M.A. and R.E. Hodson, Formation and bacterial utilization of dissolved organic carbon derived from detrital lignocellulose. Limnology and Oceanography 1989. 34(6): p. 1034-1047.
47. Swift, M., W. Heal, and J. Anderson, Decomposition in Terrestrial Ecosystems. Study in Ecology. Vol. 5. 1979, California, USA.
48. Moran, M.A., R. Benner, and R.E. Hodson, Kinetics of Microbial Degradation of Vascular Plant Material in Two Wetland Ecosystems. Oecologia, 1989. 79(2): p. 158-167.
49. Pranskevicius, M. and A. Lietuvninkas, Season-related change of the total carbon in Neris regional park soil. Environmental Engineering, Vols 1-3, ed. D. Cygas and K.D. Froehner. 2009, Vilnius-40: Vilnius Gediminas Technical Univ Press, Technika. 284-291.